26/11/2018
El control del temps de vida de les proteïnes cel·lulars és un mecanisme essencial per regular la seva activitat i perquè funcioni correctament el cicle cel·lular. Aquest cicle permet que les cèl·lules puguin dividir-se i així fer que els teixits creixin i es regenerin. El control de les diferents etapes del cicle cel·lular està exercit per diferents tipus de proteïnes que es van substituint a mesura que avança el cicle. Les cèl·lules han dissenyat un mecanisme per marcar les proteïnes que han de substituir-se per ser destruïdes, aquest procés s’anomena ubiquitinació, i la marca consisteix en la formació d’una cadena amb la proteïna ubiquitina. Les proteïnes marcades (amb ubiquitina) son eliminades per una mena de gran deixalleria cel·lular anomenada proteosoma que s’encarrega de triturar-les. La regulació d’aquest procés és molt important perquè el cicle cel·lular funcioni correctament, altrament pot comportar alteracions en la proliferació cel·lular que podrien conduir a processos cancerígens, on els teixits creixen sense cap control.
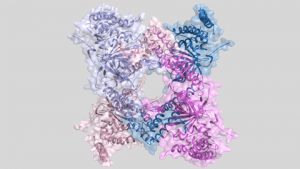
En el treball que els investigadors acaben de publicar en la revista Nature Communications presenten la caracterització estructural i el descobriment d’un nou mecanisme de regulació d’un enzim que talla les cadenes d’ubiquitina, que s’anomena USP25. Aquest enzim elimina les cadenes d’ubiquitina de les proteïnes marcades i té un impacte important en la seva funció cel·lular en evitar que siguin degradades pel proteosoma.
L’estructura tridimensional d’aquest enzim, obtinguda gràcies a la cristal·lografia de proteïnes i a la llum del sincrotró ALBA, ha permès observar la presència d’un assemblatge proteic amb dos tipus diferents d’estructura quaternària: tetràmer i dímer. I el que és més important, el tetràmer és inactiu i el dímer és actiu. Per tant l’alternança entre aquests dos assemblatges regula l’activitat d’aquest enzim i, de retruc, el temps de vida d’importants proteïnes cel·lulars.
L’estudi s’ha realitzat en el laboratori del Dr. David Reverter, que dirigeix el grup d’estructura de proteïnes del Institut de Biotecnologia i Biomedicina de la UAB (IBB), i també hi ha col·laborat el grup de la Dra. Virginia Amador, del centre de recerca biomèdica IDIBAPS, a l’Hospital Clínic. El primer autor del treball ha estat el Dr. Bing Liu, vinculat també a l’IBB i al Departament de Bioquímica i de Biologia Molecular de la UAB.
Referència:
Liu, B., Surena-Gomez, M., Zhen, Y., Amador, V., Reverter, D. A quaternary tetramer assembly inhibits the deubiquitinating activity of USP25. Nature Communications (2018). DOI: 10.1038/s41467-018-07510-5.
