Investigadors de l’IBB-UAB han fabricat 4 molècules de només 7 aminoàcids amb capacitat d’autoassemblar-se per formar nanomaterials per a biomedicina i nanotecnologia de manera més ràpida i econòmica, inspirant-se en el tipus d’assemblatge natural de les fibres amiloides.
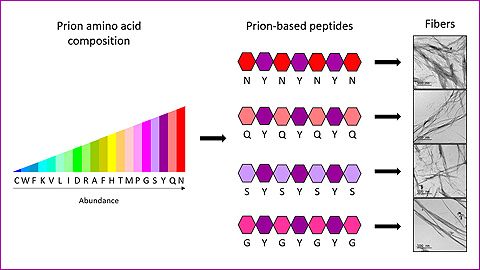
Amb els nous heptapèptids, els investigadors de l’IBB-UAB han demostrat que només amb 4 tipus d’aminoàcids diferents distribuïts de manera específica, i combinats sempre amb un mateix cinquè tipus, és suficient per tenir el codi complert que permet formar fibres priòniques sintètiques.
Investigadors de l’Institut de Biotecnologia i de Biomedicina (IBB-UAB) han generat 4 pèptids -molècules més petites que les proteïnes- capaços d’autoassemblar-se de manera controlada per formar nanomaterials. La recerca, publicada a la revista ACS Nano, ha estat realitzada per Salvador Ventura, Marta Díaz i Susanna Navarro (IBB-UAB) i ha comptat amb la col·laboració d’Isabel Fuentes i Francesc Teixidor (Institut de Ciència dels Materials de Barcelona, ICMAB-CSIC).
Les noves molècules estan formades per una cadena de 7 aminoàcids, cadascuna d’elles utilitzant-ne sols dos tipus diferents, el que agilita i abarateix significativament els processos de creació d’estructures amiloides sintètiques funcionals per fabricar nanomaterials d’aplicació en biomedicina i nanotecnologia.
En biotecnologia, generar estructures amiloides sintètiques funcionals per formar nanoestructures inspirant-se en com es creen de manera natural no és nou. L’assemblatge de proteïnes en fibres estables permet generar arquitectures supramoleculars que cap proteïna aïllada no pot assolir i que s’usen com a nanoconductors, estructures fotovoltaiques, biosensors o catalitzadors.
Molt recentment s’han imitat seqüències de proteïnes priòniques –també amiloides- per formar nanomaterials. L’interès d’aquestes seqüències rau en què s’assemblen de manera més lenta i controlada, formant nanoestructures molt ordenades i no tòxiques. Però en ser seqüències molt llargues, de més de 150 aminoàcids, resulten molt difícils i cares de sintetitzar.
“Amb el nostre treball hem demostrat que amb un disseny adequat la mida de les seqüències priòniques sintètiques es pot reduir fins a només 7 aminoàcids, conservant les mateixes propietats. Els 4 pèptids que hem fabricat són les estructures més curtes d’aquest tipus assolides fins ara capaces de formar assemblatges fibril·lars estables”, explica Salvador Ventura, investigador de l’IBB i del Departament de Bioquímica i Biologia Molecular de la UAB.
Exemples que demostren la seva eficàcia
En la seva recerca, els investigadors han comprovat l’estabilitat i funcionalitat dels quatre pèptids fabricats. Han construït un dels nanomaterials de caràcter biològic més resistents a la degradació descrits fins ara, uns nanocables recoberts amb plata que podrien actuar com a nanoconductors elèctrics i uns minienzims fibril·lars capaços de catalitzar la formació de nanomaterials orgànics.
Les aplicacions de les noves molècules són múltiples, però els investigadors les volen centrar “en la generació de nanoconductors elèctrics, i aprofitar el nostre coneixement de l’estructura amiloide per generar fibres sintètiques que puguin catalitzar noves reaccions químiques. L’objectiu final seria generar materials híbrids peptídics-inorgànics que puguin fer reaccions complexes, com les que fan, per exemple, els fotosistemes de les plantes”, indica l’investigador de l’IBB.
Les regions dels prions, el quid de la qüestió
Per generar els nous pèptids, els investigadors de l’IBB s’han basat en unes seqüències específiques de les proteïnes priòniques, anomenades regions de prions (PrDs). “Hem estudiat quins aminoàcids són més freqüents i com estan distribuïts en aquestes regions, demostrant que només amb 4 tipus d’aminoàcids diferents distribuïts de manera específica i combinats sempre amb un mateix cinquè tipus, és suficient per tenir el codi complert que permet formar fibres priòniques sintètiques. De fet, cadascun dels heptapèptids dissenyats (mini-PrDs) consta només de dos tipus diferents d’aminoàcids”, assenyala Salvador Ventura.
El treball demostra la capacitat d’assemblar-se dels mini-PrDs en nanoestructures molt ordenades, quelcom que es pensava era impossible, degut a la gran presència d’aminoàcids polars. Els pèptids aconseguits són més polars que cap altre de mida similar utilitzat fins ara per formar amiloides sintètics, el que permet, per exemple, que funcionin en les mateixes condicions que els enzims naturals.
Amb aquest estudi, els investigadors del grup de Plegament de Proteïnes i Malalties Conformacionals de l’IBB que dirigeix Salvador Ventura, obren una nova línia en la seva recerca, centrada en el disseny de nanomaterials. “No hem fet mai nanotecnologia, però a la vegada l`hem estat fent sempre, perquè la nostra força rau en el coneixement del mecanisme molecular de l’assemblatge de proteïnes en estructures amiloides. Durant molt de temps hem estat treballant per elaborar estratègies que evitin aquest fenomen en malalties neurodegeneratives. Aquest coneixement ens ha permès poder arribar a dissenyar les noves molècules que proposem ara per fabricar nous nanomaterials”, conclou Ventura.
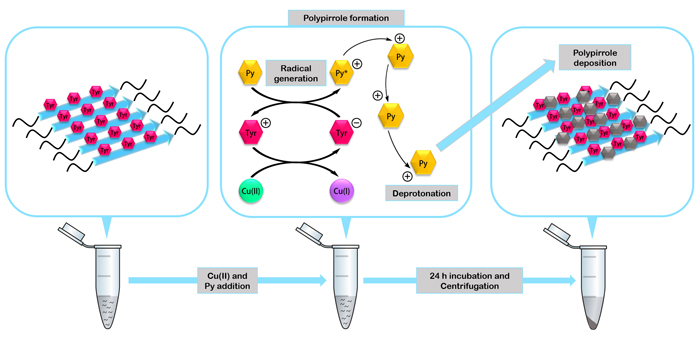
Els pèptids s’assemblen per formar minienzims capaços de catalitzar la formació de nanomaterials com el polímer conductor polipirrol.
Referència: Minimalist Prion-Inspired Polar Self-Assembling Peptides. Díaz-Caballero M, Navarro S, Fuentes I, Teixidor F, Ventura S. ACS Nano. 2018 doi: 10.1021/acsnano.8b00417. https://pubs.acs.org/doi/10.1021/acsnano.8b00417
