Un estudi liderat per l’IBB-UAB ha identificat el mecanisme molecular pel qual una proteïna, en portar les mutacions genètiques associades a una malaltia minoritària anomenada distròfia muscular de cintures de tipus 1G, accelera la seva tendència a formar fibres amiloides i acaba provocant la malaltia. La recerca, publicada a Cell Reports, permetrà obrir camí en l’estudi de possibles tractaments.
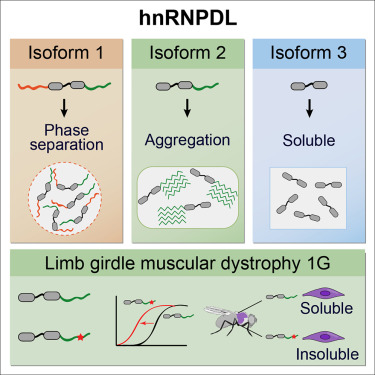
La distròfia muscular de cintures (LGMD, per les sigles en anglès) és un grup de malalties hereditàries rares que es caracteritzen per debilitat i atròfia en la musculatura de les cintures pelviana i escapular, així com en les extremitats. La de tipus 1G (LGMD1G) s’associa a dues possibles mutacions genètiques en una proteïna, anomenada hnRNPDL. Es tracta d’una proteïna molt poc coneguda. Només se sap que existeix a les cèl·lules en tres formes funcionals (isoformes) i que pot portar les mutacions genètiques vinculades a la malaltia.
Un equip de recerca liderat per l’Institut de Biotecnologia i de Biomedicina de la Universitat Autònoma de Barcelona (IBB-UAB) explica ara el comportament d’aquesta proteïna, el seu paper en les cèl·lules i el fenotip causat per les mutacions genètiques associades a l’LGMD1G, en un estudi publicat a Cell Reports.
La recerca ha constatat que una de les isoformes de la proteïna presenta una major tendència a formar fibres amiloides -agregats proteics tòxics- i que aquesta tendència a l’agregació es veu accelerada significativament quan conté les mutacions genètiques de la malaltia, fet que impedeix el seu correcte funcionament.
“Per primera vegada aportem un coneixement sòlid sobre l’efecte de les mutacions genètiques en el procés d’agregació de la proteïna hnRNPDL”, assenyala Salvador Ventura, investigador de l’IBB-UAB i coordinador de l’estudi. “A partir de dades obtingudes en Drosophila, hem pogut suggerir el possible mecanisme de la malaltia: que és la pèrdua de la funció de la proteïna, un cop forma els agregats, la que desencadena la distròfia. Una hipòtesi que corroboren les primeres dades que comencem a tenir en humans, encara no publicades, i que obririen camí per investigar possibles tractaments”.
Gràfic de les tres formes de la proteïna estudiades en l’article i de l’estudi fet amb la variant majoritària, la que té més tendència a formar fibres amiloides, en un model transgènic de mosca Drosophila.
Comportament diferencial
Per dur a terme l’estudi, s’ han analitzat en primer lloc la presència i comportament de les tres isoformes amb què la proteïna es troba a les cèl·lules: amb tres, dos o un dominis proteics -regions independents -. Posteriorment s’ha estudiat l’efecte de les mutacions genètiques en la variant amb major presència.
La isoforma amb dos dominis és la majoritària a les cèl·lules i també, sorprenentment per als investigadors, la que té més tendència a formar agregats. Els investigadors han vist també que la isoforma amb tres dominis té una tendència major a fer un procés anomenat separació de fase, descobert fa molts pocs anys i amb una gran rellevància biològica, que podria actuar com a preventiu contra l’agregació.
“El que hem vist és que quanta major tendència té la proteïna a fer separació de fase, menys en té de formar agregats. Fins ara es pensava que la separació de fase era un procés que donava lloc a posteriori a l’agregació de tipus amiloide i nosaltres hem vist que no sempre és així”, explica Salvador Ventura.
L’estudi s’ha fet tant in vitro, com en cèl·lules humanes. També en un model transgènic de Drosophila, en què les mosques expressen la variant natural o cadascuna de les formes associades a la malaltia.
La recerca, en què ha participat també la investigadora predoctoral de l’IBB-UAB Cristina Batlle, s’ha realitzat amb la col·laboració d’investigadors del grup de recerca de J. Paul Taylor, del St. Jude Children’s Research Hospital de Memphis (EUA) i del grup de recerca de Xavier Salvatella, de l’Institut de Recerca Biomèdica de Barcelona.
Article: Batlle C, Peiguo Y, Coughlin M, Messing J, Pesarrodona M, Szulc E, Salvatella X, Hong Joo K,Taylor JP, Ventura S. hnRNPDL Phase Separation Is Regulated by Alternative Splicing and Disease-Causing Mutations Accelerate Its Aggregation. Cell Reports (January 2019). https://doi.org/10.1016/j.celrep.2019.12.080
