Descobert el mecanisme d’adhesió a les cèl·lules humanes de Mycoplasma genitalium

Investigadors de l’IBB-UAB i de l’IBMB-CSIC han descobert el mecanisme pel qual el bacteri Mycoplasma genitalium (Mge) s’adhereix a les cèl·lules humanes. Aquest patogen humà de transmissió sexual és responsable de diverses patologies del tracte urogenital. El descobriment obre les portes a definir noves estratègies terapèutiques contra aquest patogen emergent que està desenvolupant resistència a la majoria d’antibiòtics disponibles.
Investigadors de l’Institut de Biologia Molecular de Barcelona (IBMB-CSIC) i de l’Institut de Biotecnologia i Biomedicina (IBB-UAB) han descobert el mecanisme pel qual el bacteri Mycoplasma genitalium (Mge) s’adhereix a les cèl·lules humanes. Aquesta adhesió és essencial per a l’establiment de la infecció i el posterior desenvolupament de la malaltia.
El treball, publicat a la revista Nature Communications, ha estat liderat per Ignacio Fita, professor d’investigació de la Unitat de Biologia Estructural de l’IBMB-CSIC, i Òscar Quijada i Jaume Piñol, del laboratori de Biologia Molecular de l’IBB-UAB. El primer autor del treball és David Aparicio, investigador postdoctoral de l’IBMB-CSIC.
Mge és un patogen emergent responsable de diverses infeccions genitourinàries. En homes, és una de les principals causes d’uretritis (15-20%) i en dones, s’ha associat a quadres de cervicitis, malaltia inflamatòria pèlvica (PID), part prematur i avortament espontani.
Fins ara se sabia que l’adhesió del bacteri al tracte genitourinari té lloc per mitjà d’unes proteïnes, denominades adhesines, que reconeixen receptors específics en la superfície de les cèl·lules. En el cas d’Mge, aquests receptors cel·lulars es coneixen genèricament amb el nom d’àcids siàlics. Altres patògens importants com el virus de la grip també utilitzen els àcids siàlics com a receptors per unir-se a les cèl·lules.
En aquest estudi, els investigadors de l’IBMB-CSIC han determinat l’estructura tridimensional de l’adhesina P110 d’Mge unida a aquests receptors cel·lulars.
“Hem fet cristalls que contenien l’adhesina P110 unida a àcids siàlics i els hem difractat amb raigs X, la qual cosa ens ha revelat la posició exacta dels àtoms en la proteïna i hem pogut definir l’estructura en tres dimensions”, explica David Aparicio, investigador de l’IBMB. Aquests experiments s’han dut a terme a la línia de llum Xaloc del Sincrotró ALBA de Cerdanyola del Vallès, mitjançant cristal·lografia de raigs X.
Paral·lelament, científics de l’IBB-UAB han realitzat estudis in vivo amb cèl·lules humanes i han demostrat que mutacions en llocs concrets de la proteïna P110 impedeixen la unió d’Mge. Aquests resultats han permès confirmar la informació derivada de l’estructura tridimensional obtinguda.
Els resultats permeten entendre les bases moleculars de la unió d’Mge amb les cèl·lules humanes. “D’una banda, hem aconseguit informació clau sobre el procés de colonització, és a dir, la presa de contacte del patogen amb les cèl·lules de l’hoste. De l’altra, això ens permet desenvolupar fàrmacs alternatius als antibiòtics capaços de bloquejar l’adhesió d’Mge a les cèl·lules, com molècules que mimetitzin els receptors cel·lulars, o que estimulin la formació d’anticossos que inhibeixin la funció de les adhesines”, explica Òscar Quijada, investigador de l’IBB.
La investigació ha propiciat la sol·licitud d’una patent internacional i s’ha iniciat una col·laboració amb el servei i el grup de recerca en microbiologia del Campus Vall d’Hebron amb l’objectiu de lluitar contra l’aparició de resistències.
La resistència a antibiòtics
Actualment, les infeccions d’Mge són tan freqüents com les de gonorrea, una de les infeccions de transmissió sexual més conegudes. A més, Mge s’està convertint en un superbacteri resistent a tots els antibiòtics disponibles actualment, fet que aviat ens deixarà sense alternatives terapèutiques. Entendre el mecanisme que permet la infecció pot ajudar a definir nous tractaments per combatre-la.
La resistència a antibiòtics és un problema cada vegada més prevalent. Mitjançant canvis genètics, molts bacteris han desenvolupat la capacitat de resistir als antibiòtics i continuar reproduint-se. Tot i que és un procés natural, el mal ús i l’abús d’aquests medicaments està accelerant el procés.
Atès que Mge està desenvolupant resistència a tots els antibiòtics disponibles, trobar una estratègia terapèutica alternativa és especialment rellevant. Els resultats obtinguts són essencials per al disseny de nous fàrmacs, ja que permeten definir l’adhesió a escala molecular.
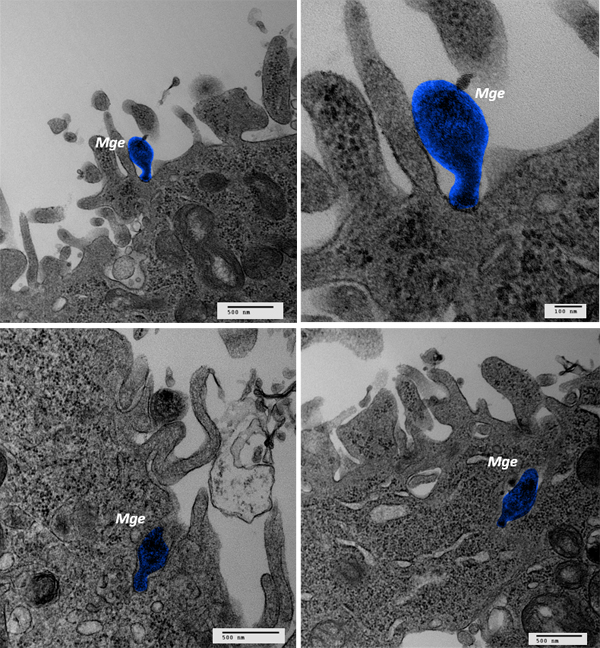
Imatges de microscòpia electrònica de transmissió, on s’observa el bacteri Mycoplasma genitalium (Mge) adherit a la superfície d’una cèl·lula humana (imatges superiors) i penetrant a l’interior d’aquestes cèl·lules (imatges inferiors). La imatge ha estat editada per facilitar la identificació del micoplasma (acolorit en blau).
Article: David Aparicio, Sergi Torres-Puig, Mercè Ratera, Enrique Querol, Jaume Piñol, Oscar Q. Pich, and Ignacio Fita. Mycoplasma genitalium adhesin P110 binds sialic-acid human receptors. Nature Communications DOI 10.1038 / s41467-018-06963-i
