Un estudi liderat per David Reverter, Júlia Lorenzo i F. Xavier Avilés, investigadors del IBB i del Departament de Bioquímica i Biología Molecular de la UAB, han identificat un nou enzim, CPO, amb què es completa el conjunt de molècules implicades en la digestió de la majoria de proteïnes que obtenim a partir dels aliments. La caracterització de la seva estructura i el seu mecanisme molecular han estat publicats a PNAS, la prestigiosa revista científica de l’Academia de Ciències de USA.
Les proteïnes i els pèptids que ingerim són components essencials del nostre organisme, fins al punt que quasi la meitat de les unitats que formen les nostres proteïnes, els aminoàcids, s’obtenen únicament a partir de l’alimentació. Són els anomenats aminoàcids essencials (la resta els podem sintetitzar directament a les nostres cèl·lules). Aquest procés s’anomena digestió i els enzims proteolítics, presents en el nostre sistema digestiu, juguen un paper molt important a l’hora de trencar o “digerir” els pèptids i proteïnes dels aliments en aquestes unitats més petites perquè puguin ser absorbides a l’intestí i reutilitzades.
D’entre tots els enzims proteolítics presents en el sistema digestiu, les carboxipeptidases juguen un paper essencial en l’alliberament dels aminoàcids. Fins ara es coneixien carboxipeptidases amb activitat sobre quasi tots els 20 aminoàcids que formen les proteïnes, però mancava trobar una classe de carboxipeptidases capaç d’alliberar aminoàcids amb càrregues negatives (glutàmic i aspàrtic, importants biològicament).
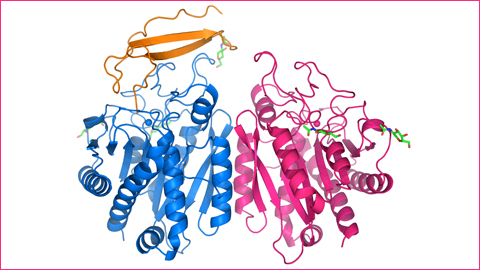
En el treball que els investigadors acaben de publicar en la revista PNAS presenten la caracterització estructural i el mecanisme d’acció d’una nova carboxipeptidasa de l’intestí prim, anomenada CPO, que presenta especificitat de reconeixement enfront aquests aminoàcids.
L’estructura tridimensional d’aquest enzim, obtinguda gràcies a la cristal·lografia de proteïnes i la llum del sincrotró ALBA, ha permès observar clarament que la presencia d’un sol aminoàcid d’arginina en la butxaca d’especificitat de l’enzim és suficient per conferir aquesta capacitat de reconèixer i digerir pèptids i proteïnes amb aminoàcids carregats negativament.
D’aquesta manera, la combinació de l’activitat de la CPO, descrita en aquesta recerca, amb la de les ja conegudes carboxipeptidases pancreàtiques, completen el ventall de la digestió de la gran majoria de proteïnes de la nostra alimentació, un procés indispensable per la vida.
L’estudi s’ha realitzat gràcies a una col·laboració entre el grup dels Drs. Francesc X. Avilés i Júlia Lorenzo, amb una llarga trajectòria en l’estudi d’aquests enzims proteolítics, i el Dr. David Reverter, que dirigeix el grup de cristal·lografia de proteïnes, on s’ha caracteritzat l’estructura tridimensional de la CPO. Els primers autors del treball han estat el Dr. Javier Garcia Pardo, investigador postdoctoral del Institut Català de Nanociència i Nanotecnologia (ICN2), vinculat també al IBB i al departament de Bioquímica i Biología Molecular de la UAB, i la Dra. Maria del Carmen Garcia Guerrero, vinculada al IBB i al departament de Bioquímica i Biologia Molecular de la UAB. També cal destacar la col·laboració del premi Nobel de Química, Dr. Robert Huber, del Instituto Max Planck de Bioquímica de Munich (Alemania), que hi ha participat activament.
Referència: Garcia-Guerrero MC, Garcia-Pardo J, Berenguer E, Fernandez-Alvarez R, Barfi GB, Lyons PJ, Aviles FX, Huber R, Lorenzo J, Reverter D. (2018). Crystal structure and mechanism of human carboxypeptidase O: Insights into its specific activity for acidic residues. Proc Natl Acad Sci USA. DOI: 10.1073/pnas.1803685115.
http://www.pnas.org/content/early/2018/04/09/1803685115
